ما انسانها دوست داریم فکر کنیم که دیانایما در هستهی سلولهایمان بهخوبی محافظت میشود؛ ولی زندگی برای این کد ژنتیکی سختکوش به این سادگیها هم نیست.
جدا از اثر مخرب پرتوهای فرابنفش و یونیزه کننده، طیف وسیعی از فعالیتهای معمولی درونسلولی نیز میتوانند برای دیانای مخرب باشند. خبر بد این است که آسیبهایی مانند شکستگی دو رشتهای دیانایمرتبا در بدن رخ میدهند. ولی خبر خوب این است که بدن انسان پروتئینهایی برای پاسخگویی به آسیب دارد که این مشکلات را رفع میکنند. اکنون با توجه به نتایج جدید منتشرشده توسط محققان کلینیک مایو، دانشمندان از سازوکار این پروتئینهای ترمیمی آگاهی بیشتری یافتهاند. جرج مر، بیوشیمیدان کلینیک تحقیقاتی مایو، توضیح میدهد:
این تحقیق بنیادی با هدف درک سازوکار پروتئینهایی که به آسیبهای دیانای پاسخ میدهند، انجام گرفته است. ما امیدواریم که دانش ناشی از این پژوهشها در بلندمدت برای اهداف درمانی، بهخصوص درمان سرطان مفید واقع شود.
پرتوهایی مانند گاما و ایکس میتوانند در هر دورشتهی مارپیچ دیانای برش ایجاد کنند. اگر این آسیب جبرانناپذیر باشد، منجر به مرگ آن سلول خواهند شد. ولی دکتر مر و گروه تحقیقاتی او حالتهایی را آزمایش کردند که این برشها در دیانای باعث ارسال سیگنالهایی شیمیایی برای فعالسازی پروتئینهای ترمیمی میشوند.
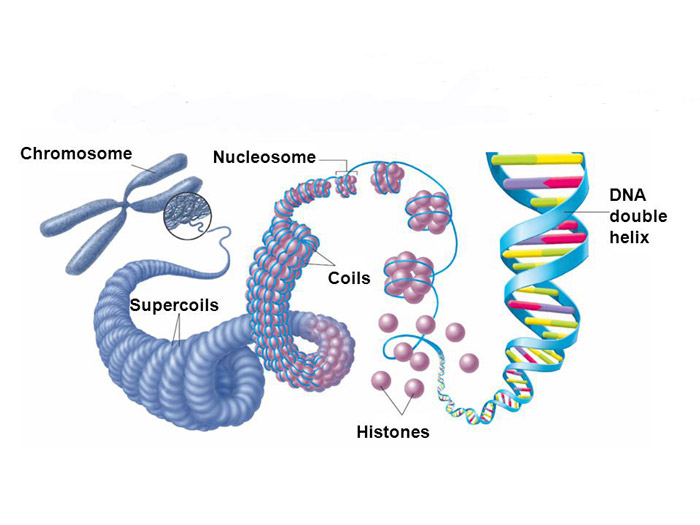
درون هستهی سلول، دیانای به دور پروتئینهایی به نام هیستونپیچیده شده است. به هر رشتهی دیانای با هشت هیستونی که دورش پیچیده است، نوکلئوزوممیگویند. هنگامی که یک شکستگی دورشتهای در دیانای رخ میدهد، هیستونها با فرآیندی شیمیایی جایگاه خود را اصلاح میکنند. در این تحقیق پژوهشگران چگونگی اصلاح این جایگاه با اتصال مولکولی به نام یوبیکوئتینبه هیستون را در هنگام شکستگی دورشتهای دیانای بررسی کردند. همچنین اینکه یوبیکوئتین چگونه به دو جایگاه در هیستون H2A متصل میشود و چگونه پروتئینهای ترمیمکننده به نوکلئوزوم متصل میشوند، بررسی شد. دکتر مر توضیح میدهد:
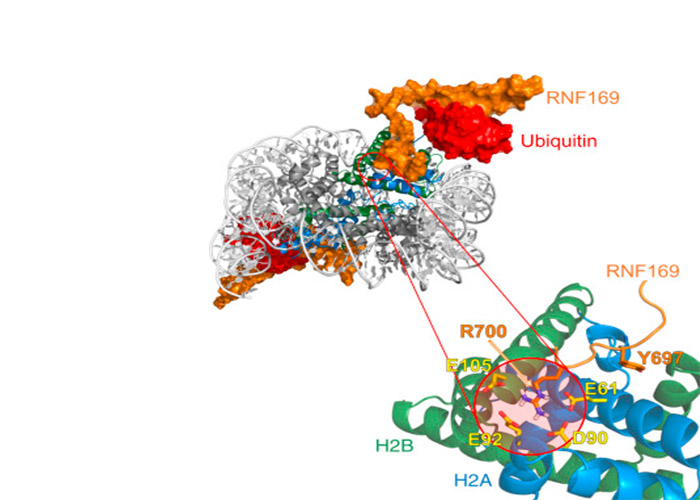
با بررسی دقیق ساختار سهبعدی اتصال پروتئین ترمیمی موسوم به RNF169 به نوکلوزوم فعالشده با یوبیکوئتین، ما چگونگی وابستگی فرآیند ترمیم به سیگنال ناشی از یوبیکوئتین را بهدقت توضیح دادیم.
کاربرد در درمانهای آینده
سازوکارهای مهم بسیاری در سلول وابسته به تشخیص پروتئینهای فعالشده با یوبیکوئتین هستند. مطالعات ساختاری مانند مورد اخیر نشان میدهند که یوبیکوئتین چگونه بهصورت اختصاصی تشخیص داده میشود. پژوهش فوق که نتایج آن در مجلهي علمی
مولکولار سل
منتشر شده است، نشان میدهد که در هنگام اتصال پروتئین ترمیمی RNF169 به نوکلئوزوم، از اتصال پروتئین ترمیمی دیگری به نام 53BP1 جلوگیری میشود. این پروتئین غیرفعال بهنوبهی خود از فعالیت یک مسیر ترمیمی دیگر دیانای جلوگیر میکند. اگر سازوکار این بازدارندگی مشخص شود، میتوان از آن جلوگیری کرد و در نتیجه مسیر ترمیمی جایگزین دوباره فعال خواهد شد. این رهیافت کمک بسیاری به درمان برخی سرطانهای تخمدان و پستان خواهد کرد.
مشاهده پست مشابه :
افشاگری مدیرعامل تلگرام درباره امنیت واتس اپ!


